はじめに
現在日本人の2人に1人が、癌になると報告されています。癌は日本人の死亡原因の30%を越えるようになりました。癌に対する3大治療法は手術、化学療法、放射線治療です。近年、免疫チェックポイント阻害剤を中心とした癌免疫療法が第4の治療として注目されています。免疫チェックポイント阻害剤は進行癌患者において劇的な効果を示すことがある一方で、耐性の出現や特有の副作用などがあり、決して万能ではありません。泌尿器科で対応する前立腺癌、腎癌、腎盂・尿管・膀胱癌と精巣腫瘍においても同じ状況です。
腫瘍研究グループは、臨床面では膀胱癌に対するBCG膀胱内注入療法や尿路上皮癌に対する化学療法等、これまでの標準治療の治療効果増大と副作用軽減を目的とした臨床研究に力を入れています。基礎研究では酸化ストレスを中心とした発癌メカニズムの解明、エピゲノムを利用した治療薬の開発、新しい癌温熱免疫療法の確立のための研究をおこなっております。その研究内容をご紹介いたします。
去勢抵抗性前立腺癌への治療アプローチ
外科的去勢、薬物による去勢状態で血清テストステロンが低値であるにもかかわらず、病勢が増悪する去勢抵抗性前立腺癌(CRPC: castration resistant prostate cancer)は、予後不良であり大きな問題となっています。近年、CRPCに対する治療として第二世代の抗アンドロゲン剤やアンドロゲン合成阻害剤、化学療法が行われていますが、治療法は未だに確立されていません。私たちの研究グループでは、69名の化学療法未治療のCRPC患者に対するレトロスペクティブ調査からアンドロゲン合成阻害剤であるアビラテロンを早期(1st or 2nd line)に使用した群において、3rd line以降に使用した群よりも無増悪生存期間が有意に延長していたことを報告しました(Nagai T, Naiki T, Iida K, et al. Prostate Int. 2018.)。現在、私たちは酸化ストレスに着目したCRPCの治療抵抗性獲得メカニズムの解明や、CRPCの新規治療薬を開発するために、前立腺癌患者を対象とした臨床研究を実施しています。(安藤亮介)
筋層非浸潤性膀胱癌の再発予防を目指して
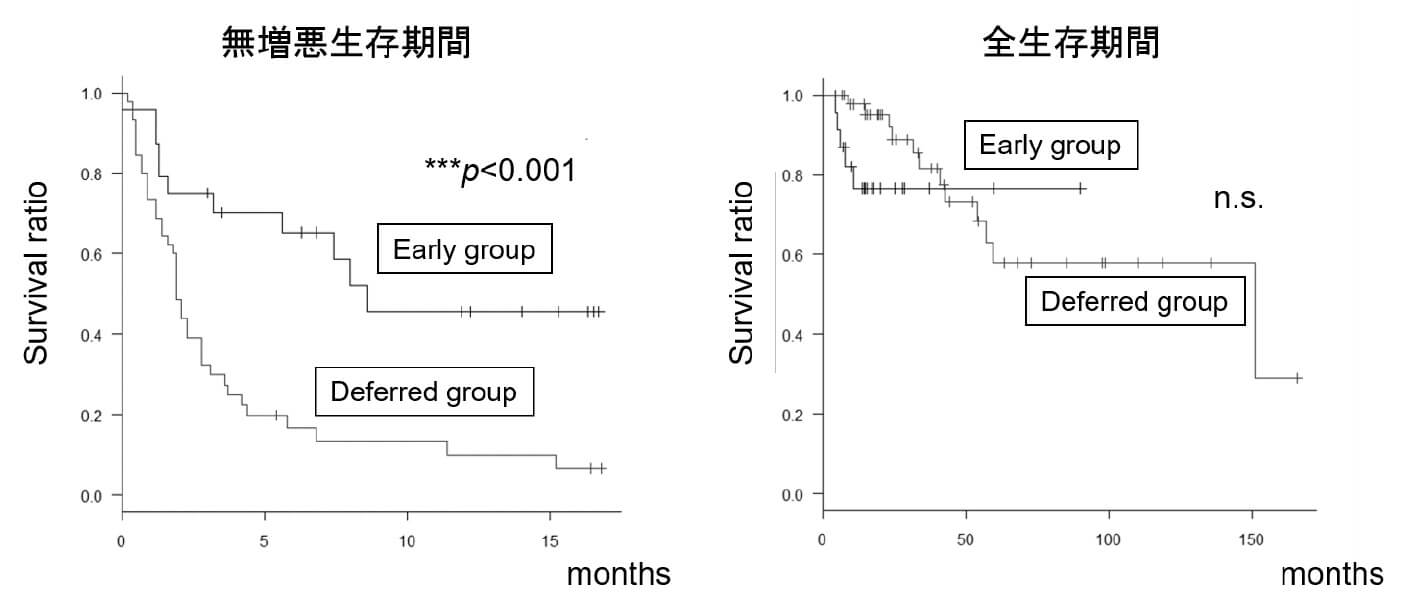
膀胱癌は膀胱粘膜から発生し、徐々に筋層へと浸潤していきます。筋層まで浸潤していなければ、TURBT(経尿道的膀胱腫瘍切除術)により膀胱温存できますが、筋層まで浸潤した膀胱癌では膀胱全摘除術が適応になります。筋層まで達しておらず、浅い層で留まっている膀胱癌を筋層非浸潤性膀胱癌と呼びますが、TURBT後の再発が非常に多く、約80%の患者さんが再発すると考えられています。
そこで、TURBT後の再発を抑えるために、ウシ結核菌を膀胱内に注入するBCG膀胱内注入療法が行われてきました。BCG膀胱内注入療法は効果がある反面、頻尿や血尿、発熱といった副作用が多く、特に高齢の患者さんでは大きな問題となっていました。私たちは、高齢者を対象にBCG投与量を減量することにより、治療効果を損なうことなく副作用を抑えられることを報告しました。
さらにTURBT後の再発を抑えるために、初回のTURBT後1-2ヶ月後に再切除を行う2ndTURも積極的に導入しています。私たちはハイリスクの筋層非浸潤性膀胱癌に対して、初回のTURBT後にBCG膀胱内中注入療法を追加する場合より、2ndTUR後にBCG膀胱内中注入療法を追加する方が再発を半分に減らすことを報告しました(Iida K, Naiki T, Kawai N, et al. BMC Urol. 2016)。私たちは日常診療を行いながら、より良い治療成績を求めて、診療データを蓄積し未来に生かそうと励んでおります。(飯田啓太郎)
難治性泌尿器悪性腫瘍に対する化学療法
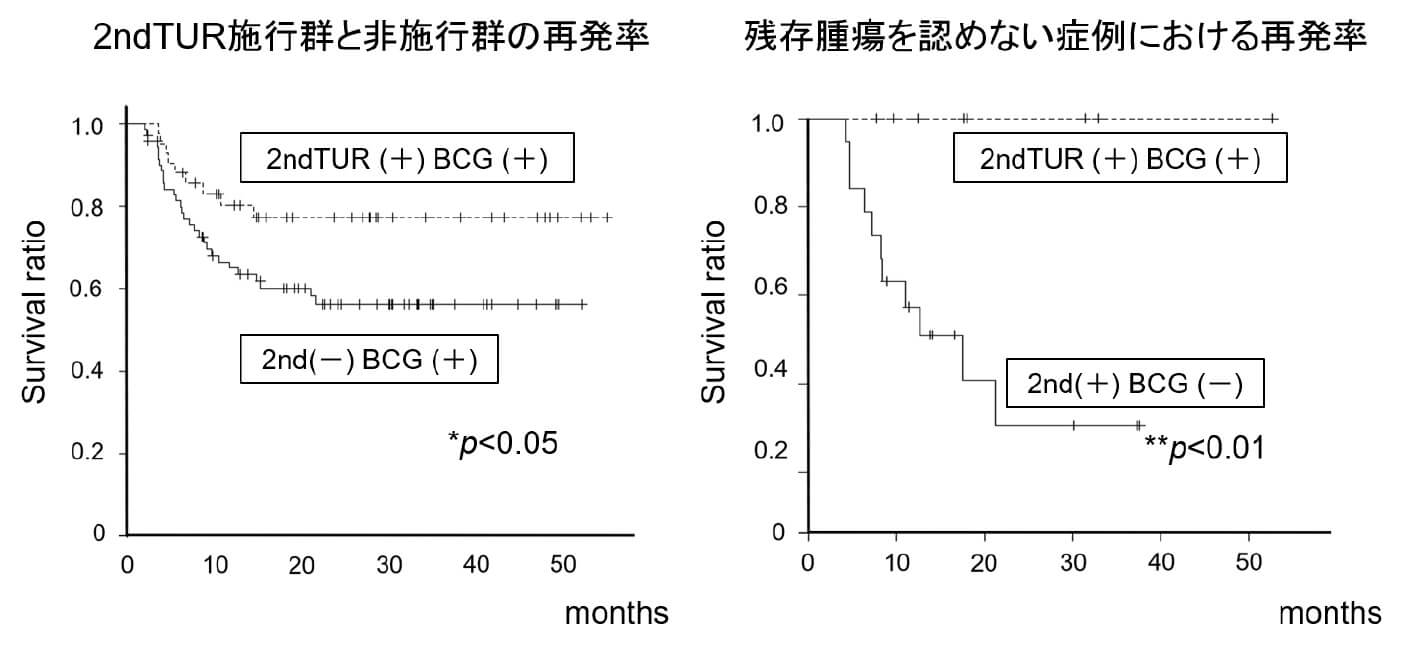
化学療法の進歩により、転移を認めていても長期生存が得られる前立腺癌、尿路上皮癌の患者さんが増加しています。私たちは10年以上前から、転移を有する尿路上皮癌の患者さんに対する化学療法に関する臨床研究を行ってきました。その中でも二次化学療法としてgemcitabineとdocetaxel(GD)の併用療法を施行し、その安全性と有効性を報告してきました(Naiki T, Kawai N, Hashimoto Y, et al. Int J Clin Oncol. 2014. Iida K, Kawai N, Naiki T, et al. Case Rep Oncol. 2015. Naiki T, Iida K, Kawai N, et al. J Rural Med. 2017. Naiki T, Iida K, Etani T, et al. Cancer Manag Res. 2018.)。GD療法により、これまでよりも長期生存を得られる転移性尿路上皮がんの患者さんが増えてきています。
近年、二次化学療法として、抗PD1抗体であるpembrolizumabの有効性が報告され、GD療法とほぼ同等の奏効結果が報告されています(Bellmunt J, de Wit R, Vaughn DJ, et al. N Eng J Med. 2017.)。しかし、どのような患者さんに、どちらのレジメンをどのタイミングで使用するべきかに関しては、一定の見解はありません。そこで現在、下記に示す前向き試験によって、検証を行っています。(内木拓)
がん患者さんに寄り添った緩和ケアを目指して
今までのがん医療の考え方では、「がんを治す」ことに関心が向けられ、患者さんの「つらさ」に対して十分な対応ができていませんでした。しかし、最近では、患者さんがどのように生活していくのかという「療養生活の質」も「がんを治す」ことと同じように大切と考えられるようになってきました。私たちは、がん診療連携拠点病院の指定要件ともなっている、「緩和ケア研修会標準プログラム」に準拠した「緩和ケア研修会」を受講し、すべての患者さんに基本的緩和ケアを提供するように努めています。さらに、緩和医療認定医である惠谷を中心として、院内の緩和ケアチームとも協同しながら、専門的緩和ケアへのスムーズな橋渡しができるように心がけています。 臨床研究では、タペンタドールやヒドロモルフォン、メサドンなどの新規オピオイドを用いた疼痛管理について発表してきました(Sugiyama Y, Tasaki Y, Naiki T, et al. Jpn J Clin Oncol. 2018.)。また、がん患者さんを悩ます便秘症に対して、ルビプロストンやナルデメジンによる効果を検証しています。患者さんが癌に立ち向かい、癌とともによりよく生きることができるように、抗腫瘍療法と緩和療法のシームレスな提供を行い、がん患者さんを援助していきます。(惠谷俊紀)
革新的がん温熱治療(ハイパーサーミア)の研究
温熱治療(ハイパーサーミア)はがんに対する治療法、あるいは放射線や抗がん剤の効果を高める補助療法として世界的に注目され、1980年代から各国で盛んに行われるようになりました。しかし、人体内の病巣を限局性に一定の温度で加温することが難しいため、未だ癌の標準治療にはなっておりません。本邦で多く使用されているがん温熱治療器は電極で患部を挟み込み8MHzの交流電流で加温するタイプです。この装置は抗がん剤や放射線治療との併用で固形癌に対する効果が示されています。一方、体表面や正常組織も加温され、癌を死滅させるほど加温することが難しいとう欠点があります。
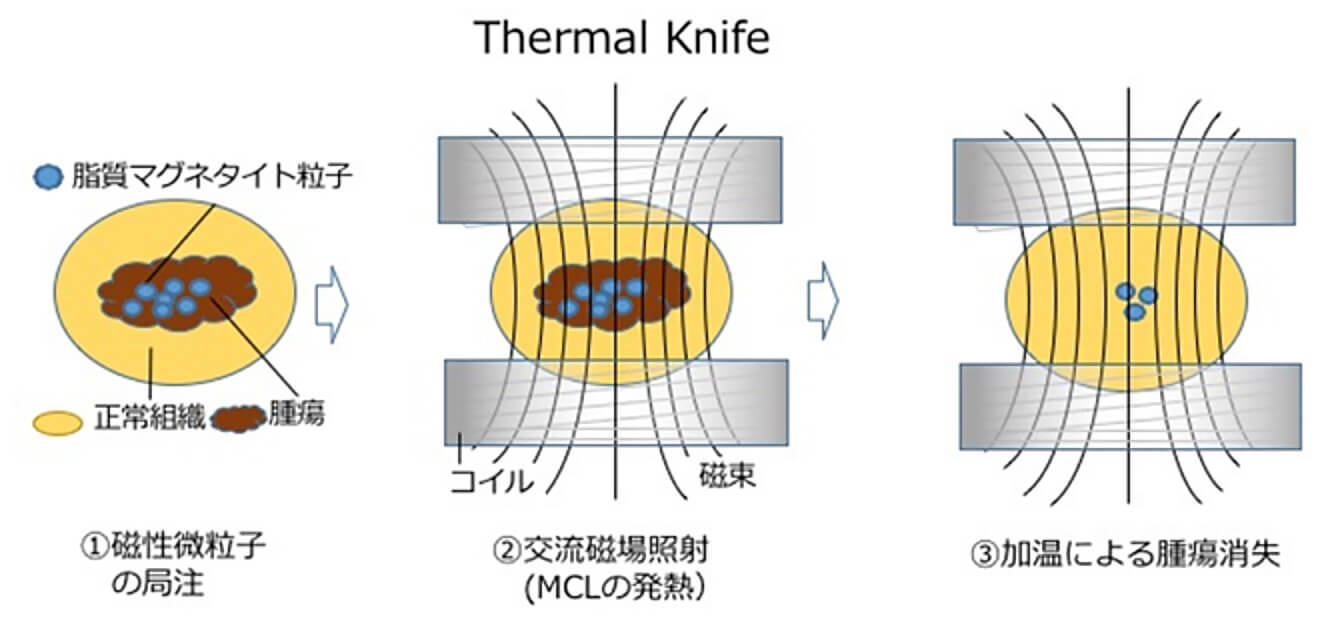
そこで私たちは磁性のある酸化鉄微粒子(Fe3O4、マグネタイト)を正電荷のリン脂質に包埋した脂質マグネタイト粒子を腫瘍組織に注入し、脂質マグネタイト粒子のみが発熱する周波数で交流磁場発生装置によって磁場照射することで腫瘍組織のみを選択的に自在に加温できる革新的ながん温熱治療の研究を進めてきました。狙った病巣を自由自在に熱で切るというイメージから、私たちは脂質マグネタイト粒子と交流磁場発生装置を用いた新しい温熱治療を”サーマルナイフ(Thermal Knife)”と名付けました。
Thermal Knifeは、従来の温熱療法からは全く想像できなかった腫瘍免疫を賦活させ、原発の腫瘍のみならず、治療していない腫瘍も退縮させることも分かりました。この治療法は癌根治の最大の障壁である転移癌も治療できることを示しており、狙った病巣のみを切り取ることによる低い副作用と、高い腫瘍特異的免疫という特徴を備えた世界でも初めての癌治療法なることを期待している。前立腺癌、腎癌そして膀胱癌を想定し、動物モデルを用いて研究を続けています
(河合憲康)
酸化ストレスの制御に着目した
新しい癌治療の開発を目指した基礎研究
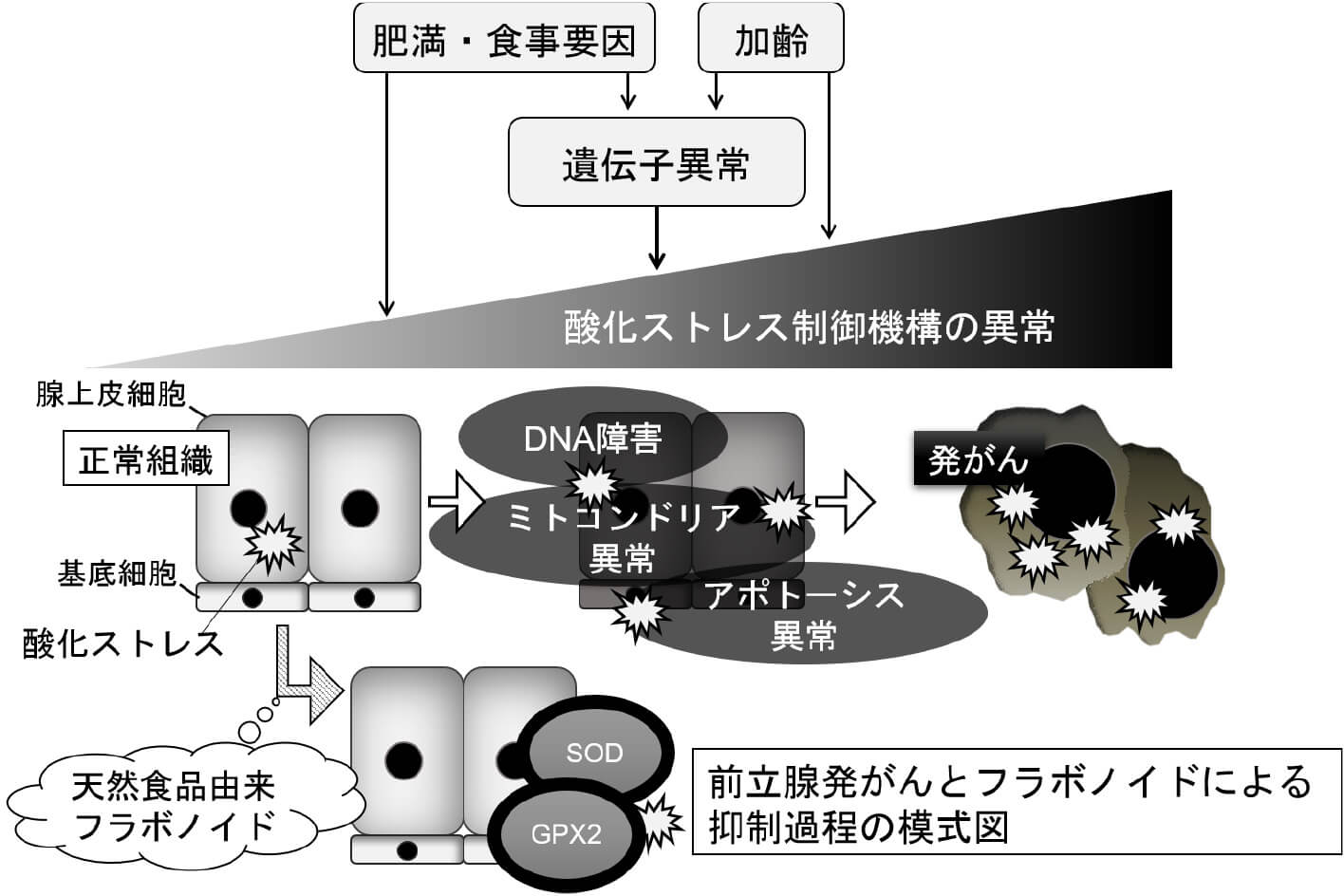
近年、ライフスタイルの欧米化に伴い、前立腺癌の罹患率は急激に上昇しています。中でも食生活の欧米化は、前立腺組織での酸化ストレスを増悪させるため、発がんを促進していると考えられています。しかし、前立腺発がんにおける酸化ストレス調節機構には未解明な点が多く、有効な発がん予防物質はありません。これまで私たちは、ヒトの臨床経過を忠実に再現した前立腺癌転移動物モデルを樹立し、酸化ストレス調節機構のキー遺伝子であるGlutathione S transferase Pi(GSTP)やGlutathione peroxidase(GPX)が、前立腺癌の進展に重要であることを証明してきました(Naiki T, Asamoto M, Toyoda-Hokaiwado N, et al. Prostate. 2012. Naiki T, Naiki-Ito A, Asamoto M, et al. Carcinogenesis. 2014.)。そして現在、抗酸化フラボノイドによって、GPXを中心とした酸化ストレス調節機構を制御することで、前立腺発がんや進展を予防する新しい治療法樹立に向けた研究を行っています。(内木拓)
エピゲノム修飾薬を用いた泌尿器悪性腫瘍の
新規治療法の確立を目指して
泌尿器科で治療する癌には、前立腺癌、尿路上皮癌、腎癌、精巣悪性腫瘍などがあります。これらの癌に対する治療は日々進歩していますが、いまだ転移性腫瘍に対する有効な治療は限られており、治療成績も十分ではありません。
私たちは、名古屋市立大学大学院薬学研究科創薬基盤科学研究所や京都府立医科大学統合医科学専攻医薬品化学教室との共同研究として、前立腺癌に対するエピゲノム治療薬の開発に取り組み、その成果を発表してきました(Etani T, Suzuki T, Naiki T, et al. Oncotarget. 2015.)。今後、その研究成果をさらに発展させ、尿路上皮癌や精巣悪性腫瘍へ広く応用可能なエピゲノム治療薬の可能性を追求すべく、研究を行っております。(惠谷俊紀)



